Lei de Avogadro
A lei de Avogadro constitui um caso especial da lei dos gases ideais. Refere-se à relação de proporcionalidade directa existente entre o número de átomos ou moléculas de um gás (convertíveis para valores de massa ou quantidade de substância) e o volume por ele ocupado, mantendo-se a pressão e a temperatura constantes. A lei de Avogadro pode ser enunciada da seguinte forma:
A pressão e temperatura constantes, volumes iguais de gases ideais contêm o mesmo número de partículas (átomos ou moléculas).
Como tal, pode-se concluir que o número de partículas existentes num determinado volume de gás é independente do seu tamanho ou massa. Tal implica que iguais volumes de dioxigénio e dicloro, por exemplo, desde que apresentem comportamento de gás ideal e estejam à mesma pressão e temperatura, contêm o mesmo número de moléculas. No caso de um gás real, podem ocorrer desvios mais ou menos significativos conforme o grau de afastamento das condições de gás ideal. A lei de Avogadro pode traduzir-se matematicamente por V = n  k
k 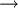 V
V  n, a pressão e temperatura constantes (k é uma constante; no caso de se tratar de um gás ideal, k = RT/p). Assim, é possível estabelecer-se uma relação matemática entre uma quantidade de substância inicial de gás (ni) e o volume por ele ocupado (Vi) com os correspondentes valores finais (nf e Vf, respectivamente), após a adição/remoção de uma nova quantidade de gás ou um aumento/diminuição do volume, mantendo a pressão e temperatura constantes. Atendendo a que Vi/ni = k = Vf/nf, verifica-se que:
n, a pressão e temperatura constantes (k é uma constante; no caso de se tratar de um gás ideal, k = RT/p). Assim, é possível estabelecer-se uma relação matemática entre uma quantidade de substância inicial de gás (ni) e o volume por ele ocupado (Vi) com os correspondentes valores finais (nf e Vf, respectivamente), após a adição/remoção de uma nova quantidade de gás ou um aumento/diminuição do volume, mantendo a pressão e temperatura constantes. Atendendo a que Vi/ni = k = Vf/nf, verifica-se que:
Como consequência da lei de Avogadro, o volume de uma mole de qualquer gás com comportamento de gás ideal é sempre o mesmo, a uma determinada pressão e temperatura. De facto, nas condições PTN (pressão e temperatura normais: 1,33322 × 105 Pa ou 1 atm e 273,15 K ou 0 ºC), o volume molar de um gás ideal é 22,40 dm3 (ou L).
Foi Amedeo Avogadro, um físico italiano que viveu nos séculos XVIII e XIX, quem primeiro verificou, em 1811[1], a relação existente entre estas variáveis. Apoiado no seu trabalho sobre os gases e no trabalho desenvolvido por Joseph Gay-Lussac, um químico e físico francês seu contemporâneo, Avogadro conseguiu distinguir os conceitos de átomo e molécula, até então utilizados de forma indiscriminada. Na altura, no entanto, o seu trabalho foi acolhido pela comunidade científica com indiferença devido ao facto de publicar em revistas pouco reconhecidas pelos cientistas, de ser muito modesto e retraído e, principalmente, pela crescente importância da área então em voga, a Electroquímica. Os electroquímicos rejeitavam a ideia de um gás molecular do tipo H2, como admitido por Avogadro, pois, para eles, um composto só se formaria devido a atracções electrostáticas do tipo Na+Cl-. Por isso, o trabalho de Avogadro permaneceu na obscuridade durante 59 anos, até uma conferência internacional ocorrida em 1860 em Karlsruhe, Alemanha, 4 anos após a sua morte, ter reconhecido a enorme contribuição de Avogadro para a Química, não só para a determinação das massas das moléculas, mas também, de forma indirecta, dos átomos que as constituem. Estes conceitos de átomo e de molécula (resultante da combinação de átomos) foram consagrados nesta conferência graças ao trabalho de Avogadro. Tal permitiu unificar a Química em torno destes conceitos sólidos e fundamentados e conciliar as observações experimentais. Mais tarde, o trabalho de Avogadro sobre os gases foi aproveitado para um conjunto de determinações experimentais de massas atómicas por parte de Stanislao Cannizzaro, um químico italiano do século XIX e início do século XX, de que resultou a determinação da constante de Avogadro (NA = 6.02214 × 1023 mol-1).
Exemplo:
Para o Mercúrio:(73,9 g) x (1 mol/200,59 g) = 0,368 mol
Para o Cloro:(26,1 g) x (1 mol/35,45 g) = 0,736 mol
Qual é a relação molar entre os dois elementos?
(0,736 mol Cl/0,368 mol Hg) = 2,0
Assim, nós temos duas vezes mais moles (isto é, átomos) de Cl que de Hg. A fórmula empírica seria assim (lembre-se de colocar o cátion primeiro e o ânion por último): HgCl2 .
Fonte : https://pt.wikipedia.org/wiki/Lei_de_Avogadro












Nenhum comentário: